Histoire de l'atome
Dès l’antiquité, les premiers scientifiques grecs se sont interrogés sur la constitution de la matière. Les philosophes Thales de millet et Empédocle énoncèrent la théorie des 4 éléments, théorie selon laquelle, tous les corps sont formés exclusivement de 4 éléments : l’eau, La terre, le feu et l’air.


Aristote (à gauche) et thales de Millet (à droite) partisan de la théorie des 4 élements.
4 Siècle avant JC, Démocrite émit l’idée que la matière était constituée de petites particules indivisibles appelé atomes (insécable en grec !). Malheureusement la faible notoriété de Démocrite comparée à celle d’Aristote partisan de la théorie des 4 éléments, mit à mal la théorie de Démocrite.

Democrite, partisan de la théorie atomiste.
Pendant plus de 2000 ans, la théorie des 4 éléments fut celle communément admise et reconnue. Il faudra attendre le 19ème siècle et les travaux expérimentaux de John Dalton père de la théorie atomiste pour prouver que la théorie des 4 éléments était fausse et que la matière était constituée d’atomes.

John Dalton, pere de la théorie atomiste
Au cours du 20ème siècle, plusieurs scientifiques ont proposé leur modèle de l’atome au fur et à mesure que les connaissances évoluées.
|
1904 |
 |
 |
Au début du 20ème siècle, Thomson découvre l’électron et prend pour modèle de l’atome celui d’un pudding chargé positivement fourrée d’électron chargé négativement. |
|
1909 |
|
 |
5 Ans plus tard, Rutherford découvre que l’atome est constitué d’un élément central, le noyau. Ce dernier est 100000 fois plus petit que l’atome. Dans son modèle, les électrons tournent autour du noyau, comme les planètes autour du soleil ! |
|
1913 |
 |
 |
Pour Niels Bohr, la théorie de Rutherford est correcte mais perfectible ! Il pense que les électrons se déplacent autour du noyau sur des orbites (couche) bien définies. Il peut y en avoir plusieurs sur une seule couche ! |
|
1925 |
 |
  |
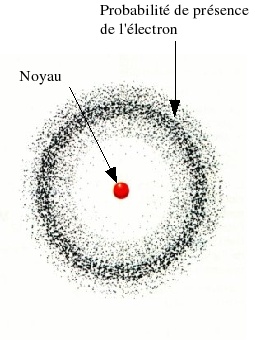
Erwin Schrödinger rejette cette idée de trajectoire de Bohr Pour lui, on ne peut connaitre les positions d’un électron précisément, mais on définit une probabilité de trouver un électron. |


