Chapitre 5 : Les transformations chimiques
I) Réaction de l'acide chlorhydrique sur le Fer.
1) Les ions presents dans l'acide chlorhydrique.
L’acide chlorhydrique contient des ions H+ et des ions Cl-.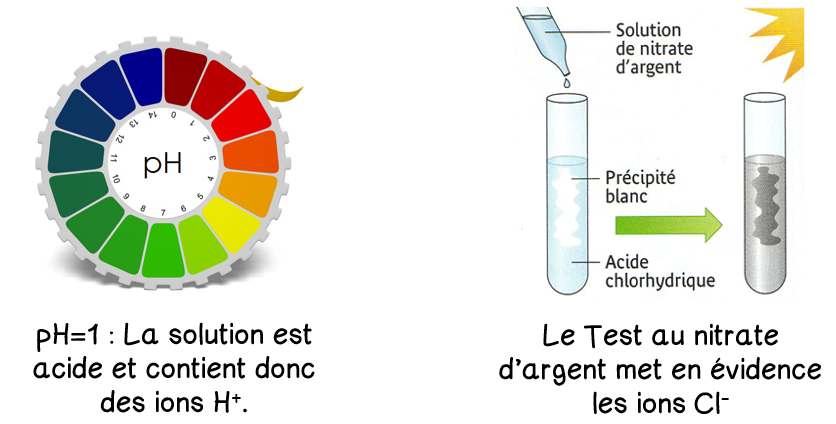
2) Réaction avec le fer.
Lors de la réaction de l’acide chlorhydrique sur le Fer, il y a apparition de bulles de dihydrogène (H2)
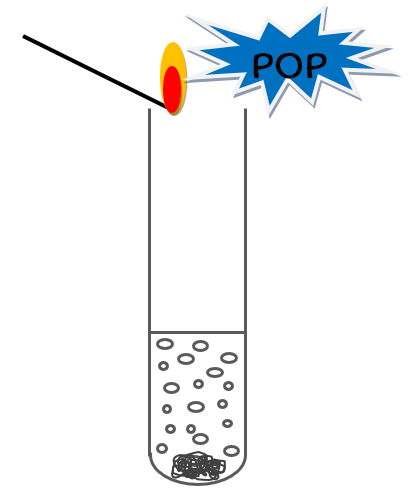
3) Que se passe-t-il dans le tube?
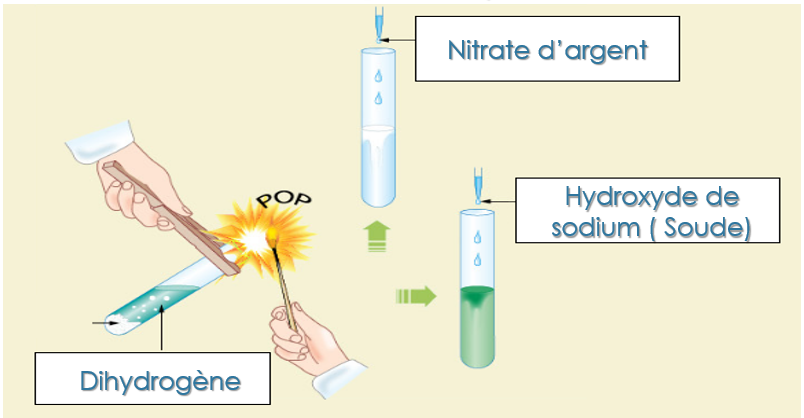
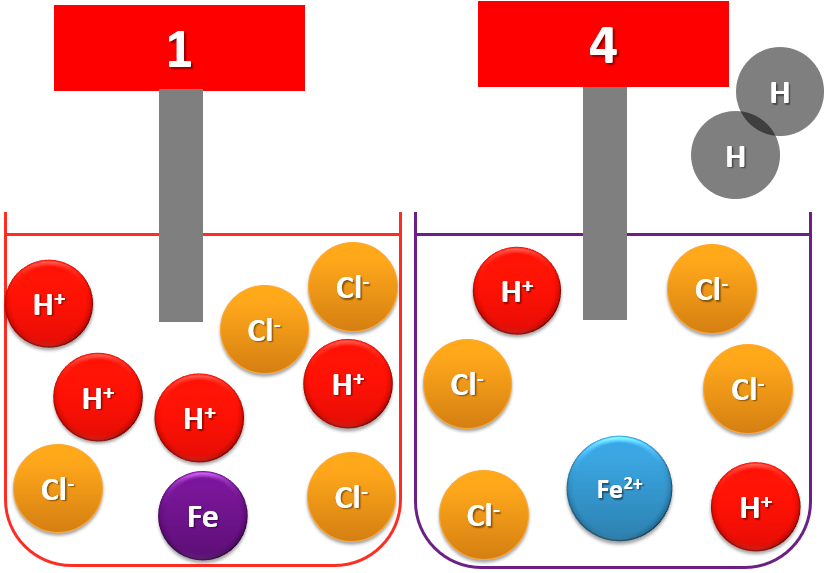
A la fin de la transformation chimique, nous observons la présence d’ions Fe2+ et Cl-.Les ions chlorure sont présents au début et à la fin de la transformation. Ils sont spectateurs et ne réagissent pas!
On observe également la augmentation du pH qui montre une diminution de la quantité des ions H+. Ils se sont transformés en molécule de dihydrogène (H2)
Bilan de la réaction :
Lors d'une transformation chimique, on a disparition des réactifs et formation de produits.
Ici, cette transformation chimique se note :
Fer + acide chlorhydrique ==> dihydrogène + solution de chlorure de fer (II)
Ou encore avec les formules
Fe + 2 H+ ==> Fe2+ + H2
II) Réaction entre un acide et une base
Lors de la réaction entre l’acide chlorhydrique et la soude, l’ion hydrogène de l’acide réagit avec l’ion hydroxyde de la base pour former de l’eau. Cette réaction dégage de la chaleur.
III) Les Piles
1) Composition d'une pile.
On constitue une pile avec deux matériaux conducteurs différents (électrodes) plongés dans une solution conductrice (électrolyte)
Cette pile convertit une partie de l’énergie chimique en énergie électrique.
2) Réaction se produisant dans une pile.
La réaction entre le Zinc et le sulfate de Cuivre a consommé les deux réactifs et formés deux produits. Le Zinc s’est transformé en ion Zinc (Zn2+) et les ions Cuivre (Cu2+) en atomes de Cuivre. Cette réaction a libéré de la Chaleur (énergie Thermique).
Zn + Cu2+ ==> Cu + Zn2+






