Chapitre 4 : Les mélanges
I) Mélanges Solides/Liquides.
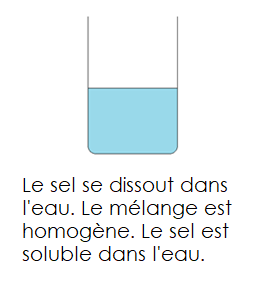
Quand on mélange le sel et l’eau, on ne voit qu’un seul composant à l’oeil nu. Le sel et l’eau forment un mélange homogène. On dit que le sel est soluble dans l’eau.
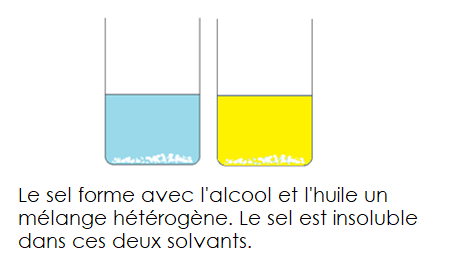
Le sel et l’huile ou encore le sel et l’alcool ne se mélangent pas. On voit toujours le sel. Le sel forme avec l’huile et l’alcool des mélanges hétérogènes. On dit que le sel est insoluble dans l’huile et dans l’alcool.
II) Soluté et solvant.
Quand on mélange du sel avec de l’eau, la substance dissoute, ici le sel, est appelé le soluté. La substance dans laquelle on dissout, ici l’eau est appelé le solvant. Lors de la dissolution d’un soluté (le sel) dans un solvant ( l’eau); le mélange obtenu est appelé une solution. On parle de solution d’eau salée.
Une solution contient plusieurs espèces chimiques alors qu’un corps pur n’en contient qu’une seule.
III) Saturation d'une solution d'eau salée
Lorsque l’on introduit trop de soluté (ici le sel) dans un solvant (ici l’eau), il ne se dissout plus. On dit que la solution est saturée. On obtient ainsi un mélange hétérogène.
La masse de soluté que l’on peut introduire au maximum dans un litre de solvant s’appelle la solubilité. Elle dépend de facteurs comme la température par exemple. Pour le sel, la solubilité est de 350g par litre environ à 20°C.
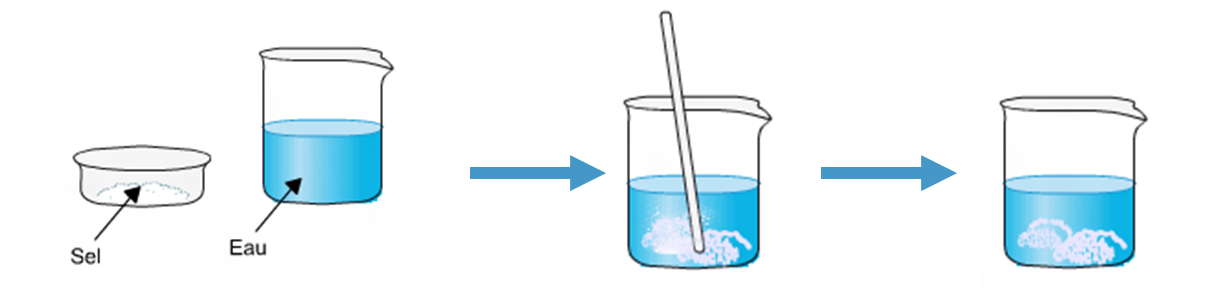
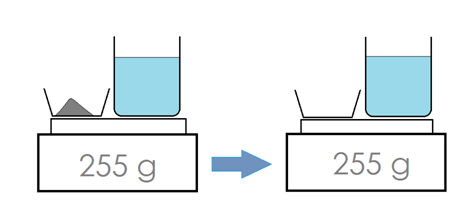
IV) Conservation de la masse lors d'une dissolution.
Quand on dissout un soluté comme le sel dans un solvant (ici l’eau), la masse totale ne change pas, car il n’y a pas de disparition de soluté ou de solvant au cours d’une dissolution.
V) Les mélanges entre liquides
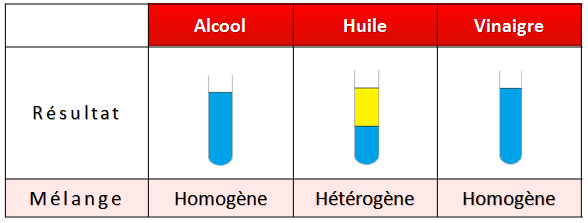
Quand on mélange deux liquides :
Si ils forment un mélange homogène, ils sont miscibles.
Si ils forment un mélange hétérogène, ils sont non miscibles.
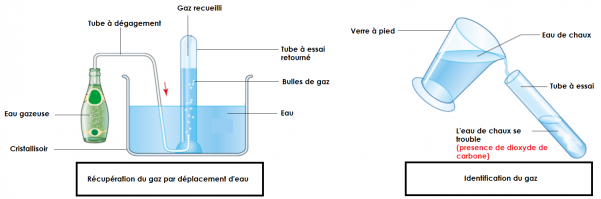
VI) Un gaz dissout dans l'eau.
Certaines eaux ou boissons contiennent un gaz dissout. On peut récupérer ce gaz par déplacement d’eau.
Ce gaz a la particularité de troubler l’eau de chaux, c’est du dioxyde de carbone.